
摘要:为提高纳米材料对Hg(Ⅱ)的吸附性能,采用化学键合方法制备了劳氏紫功能化磁性纳米材料,对其进行了表征,并用于水中Hg(Ⅱ)的吸附研究。结果表明,劳氏紫基团成功修饰到Fe3O4@SiO2表面;所制备材料以Fe3O4为核,SiO2为壳的结构,粒径约为220nm。在pH=6时,吸附可在30min内达到平衡;吸附过程符合准2级动力学方程和Langmuir吸附等温模型,属于单分子层吸附,最大吸附量为77.04mg/g;材料可循环使用10次以上,且吸附率无显著降低,具有较好的再生性能。该材料能有效吸附水体中的Hg(Ⅱ),具有吸附量大、可再生、分离快速等优点,在Hg(Ⅱ)污染水体治理及生态环境保护等方面有较好的使用前景。
 加入收藏
加入收藏
目前已有多种方法用于去除水中的重金属污染物,例如溶剂萃取,化学沉淀、膜分离、离子交换和吸附法等[1,2,3,4,5,6]。其中,吸附法具有操作简便、处理效率高、运行成本低、吸附材料种类多和来源广泛等优点,被广泛应用于重金属废水的处理[7,8,9]。但是,传统吸附材料在使用中对重金属吸附速率较慢、吸附量较小,且材料也不具有选择性吸附能力,难以满足要求,制约了吸附法在该领域中的应用。因此,设计开发低成本、无污染、高效率、可重复使用的吸附剂是该领域的一个重要研究课题[10]。
纳米材料如石墨烯、碳纳米管、纳米TiO2、g-C3N4和金属有机骨架(MOF)等,具有较高的表面能和较大的比表面积,对重金属的吸附量大[11,12,13,14,15]。近年来,纳米材料在重金属吸附领域得到了广泛的应用。但是,纳米材料颗粒小,使用后难以从水中分离回收,容易导致工艺二次污染,使用成本高。磁性纳米复合材料具有良好的磁响应性能,可方便地从水中回收,且制备简便、成本低廉、无污染,也被广泛应用于重金属离子吸附去除[16,17]。这些材料显示了良好的重金属废水处理性能,但其在溶液中的稳定性以及对重金属离子的吸附量有待进一步提高。
磁性纳米材料的表面功能化修饰,可增加材料表面的活性位点,进而提高其对重金属离子的吸附量。根据软硬酸碱理论,含N和S原子的基团与Hg(II)之间具有较强的结合力[18,19]。劳氏紫是一种含有N和S的有机试剂,和Hg(II)之间有较强的结合力。本研究采用化学键合方法,将劳氏紫联接到磁性纳米材料表面,制备一种劳氏紫修饰的功能化核壳型磁性纳米材料,对其进行表征,测试其磁响应性能,并研究对废水中重金属Hg(II)的吸附性能,以期对含Hg(II)废水的吸附处理具有借鉴作用。
1、实验部分
1.1试剂
FeCl2·4H2O、FeCl3·6H2O、正硅酸乙酯(TEOS,质量分数98%)、3-氯丙基三乙氧基硅烷(CPTMS)、无水乙醇、甲苯、浓氨水、盐酸、氢氧化钠和硝酸汞,劳氏紫,均为分析纯。电感耦合等离子体质谱测定时使用超纯水,其余用水均为去离子水。
1.2材料的制备
碱性条件下,通过Fe2+和Fe3+共沉淀制备Fe3O4,再利用溶胶-凝胶法,在碱性条件下使正硅酸四乙酯缩合在Fe3O4表面,制备核壳型Fe3O4@SiO2[20]。
然后将1.2g的Fe3O4@SiO2加入到250mL的三颈瓶中,再加入50mL无水甲苯,快速机械搅拌15min,再加入3mL氯丙基三乙氧基硅烷,使用N2保护,在80℃条件下搅拌反应8h。反应完全后,使用外加磁铁收集材料,依次分别用50mL无水甲苯和乙醇洗涤3次,然后在60℃条件下真空干燥12h,得Cl修饰的Fe3O4@SiO2,记为Fe3O4@SiO2-Cl。
在250mL的三颈瓶中加入100mLN,N-二甲基甲酰胺和0.1g劳氏紫,再加入上步制备的Fe3O4@SiO2-Cl,搅拌分散均匀,然后加入0.4g无水碳酸钾,在60℃条件下搅拌反应12h。反应完全后,自然冷却到室温,用外加磁铁收集材料,依次用30mL无水乙醇和去离子水洗涤6次,在60℃条件下真空干燥10h,得劳氏紫修饰的Fe3O4@SiO2,记为Fe3O4@SiO2-T。
1.3材料的表征与测试
采用VSM7407振动样品磁强计测试Fe3O4、Fe3O4@SiO2-Cl和Fe3O4@SiO2-T等材料的磁强度,采用JEM-2100型高分辨透射电子显微镜(TEM)对Fe3O4和Fe3O4@SiO2-T的粒径和表观形貌进行表征,采用Bio-Rad傅立叶红外光谱仪(FTIR)测试Fe3O4、Fe3O4@SiO2-Cl和Fe3O4@SiO2-T材料表面的化学官能团。
1.4材料对水中Hg(II)的吸附
所有吸附实验均使用玻璃容器。首先,将25mL质量浓度1mg/L的Hg(II)溶液加入到25mL磨口锥形瓶中,再加入20mg吸附剂,用可忽略体积的0.1mol/L的HCl溶液或0.01mol/L的NaOH溶液调节溶液的pH,然后将锥形瓶放入振荡器中恒温振荡一定时间。将磁铁放在锥形瓶外,收集材料,弃去上清液,然后将材料转移至10mL离心管中,加入适量洗脱液,振荡洗脱,利用磁铁收集材料。取适量洗脱液,采用电感耦合等离子体质谱仪或紫外-可见分光光度计测定洗脱液中Hg(II)的含量。计算材料对Hg(II)的吸附量q和吸附率E[21]:

式中,ρ0和ρe分别为初始和吸附平衡后Hg(II)的质量浓度,m为吸附剂的质量,V为溶液的体积。
2、结果与讨论
2.1材料的表征
图1为Fe3O4、Fe3O4@SiO2-Cl和Fe3O4@SiO2-T磁性纳米粒子在室温下的磁滞回曲线。
图1Fe3O4、Fe3O4@SiO2-Cl和Fe3O4@SiO2-T的磁滞回线
由图1可知,在外加磁场下,当磁滞回线经过原点时,矫顽力和磁化强度都为0,说明3种材料均为超顺磁性。Fe3O4、Fe3O4@SiO2-Cl、Fe3O4@SiO2-T磁纳米材料的最大磁化强度分别为75.30、53.72、45.38Am2/kg,磁强度依次减弱,原因是Fe3O4磁纳米粒子表面包覆了一定量非磁性SiO2层,但Fe3O4@SiO2-T仍具有较强的磁场强度。当磁性材料的磁强度高于16.30Am2/kg,材料便可从溶液中快速分离[22]。而本研究所制备Fe3O4@SiO2-T的磁强度高达45.38Am2/kg,材料在外加磁场作用下在30s内可从溶液中分离出,显示出良好的磁分离性能。
图2为Fe3O4、Fe3O4@SiO2-Cl和Fe3O4@SiO2-T的FTIR光谱。
由图2可知,Fe3O4中在波数575cm-1处存在吸收峰,应为Fe3O4中Fe-O键的特征吸收峰[23]。与Fe3O4相比,Fe3O4@SiO2-Cl在波数2926、1094cm-1处应分别为-CH2-和Si-O-Si的伸缩振动吸收。劳氏紫功能化修饰后,材料在在波数3327、1645cm-1处有吸收,应为劳氏紫分子中-NH的伸缩振动吸收。由此可见,Fe3O4磁核表面包覆了SiO2层,并且劳氏紫成功联接到了Fe3O4@SiO2表面。
为更好地说明材料的表观形貌以及Fe3O4@SiO2-T的核壳结构,采用TEM对材料进行了表征,结果如图3所示。
图3Fe3O4和Fe3O4@SiO2-T的TEM照片
由图3可知,Fe3O4和Fe3O4@SiO2-T都具有球形结构,粒径分别为200nm和220nm,并且Fe3O4@SiO2-T具有清晰的核壳结构。由Fe3O4和Fe3O4@SiO2-T的粒径可知,SiO2层厚度为10nm。均匀的球形纳米粒子能提供更大的比表面积和更多的吸附位点,有利于重金属离子的吸附。
2.2对Hg(II)的吸附
2.2.1溶液pH的影响
溶液的初始pH不仅能影响材料表面官能团性质、表面电荷、活性位点,还会影响Hg(II)在不同pH条件下的形态,对Fe3O4@SiO2-T吸附Hg(II)的影响较大[24]。溶液初始pH对Hg(II)的影响见图4。
图4溶液pH对Hg(II)吸附率的影响
由图4可知,在酸性溶液中(pH<5.0),材料对Hg(II)的吸附率较小,且随着pH的升高而变大;在中性或碱性溶液中(pH>6.0),材料对Hg(II)的吸附接近100%且保持恒定。原因是在强酸性条件下,溶液中的H+占据了材料表面的活性位点,不利于Hg(II)和N、S原子之间的配位,阻碍了Hg(II)的吸附;而在中性或碱性溶液中,H+含量较低,N和S原子可以有效地和Hg(II)之间发生配位,Hg(II)的吸附率较高。考虑到Hg(II)在强碱性溶液中的水解效应,后续实验中选择pH=6.0进行吸附实验。
2.2.2吸附时间的影响
吸附平衡时间是另一个影响Fe3O4@SiO2-T对Hg(II)吸附率的因素。吸附时间过短,吸附不能达到平衡,材料未达到最大吸附量,吸附时间过长,在实际应用中处理效率低,造成时间浪费。为此,考察了吸附时间对Hg(II)吸附率的影响,结果如图5所示。
图5吸附时间对Hg(II)吸附率的影响
由图5可知,在前30min内,吸附率随时间延长不断增大,原因是在吸附初始阶段,吸附剂表面存在大量的N和S活性吸附位点,当溶液中Hg(II)扩散到吸附剂表面时,能被吸附剂快速捕集吸附。当吸附时间超过30min后,吸附速率较缓慢,这可能是大多数活性吸附位点已经被Hg(II)占用,表面活性位点减少,吸附逐渐达到平衡。综合考虑吸附率和吸附时间,后续实验选择吸附时间为30min。
2.2.3吸附剂加入量的影响
吸附剂表面含有活性吸附位点,其加入量直接影响了活性位点的数量,进而影响Hg(II)的吸附率。为了得到较高的Hg(II)吸附率,考察了加入5~50mg的Fe3O4@SiO2-T对Hg(II)吸附率的影响,结果如图6所示。
图6吸附剂加入量对Hg(II)吸附率的影响
由图6可知,当吸附剂的加入量从5mg逐渐增加到20mg时,Hg(II)的吸附率也逐渐增大,到一定程度后保持不变。当吸附剂量达到20mg后,Hg(II)的吸附率可接近100%。很显然,当溶液中Hg(II)的量固定后,加入的吸附剂量越大,提供的活性吸附位点越多,Hg(II)的吸附率也越高。因此,随着吸附剂的加入量增大,Hg(II)的吸附率越高。后续实验中选择吸附剂量为20mg。
2.3吸附行为及机理
2.3.1吸附动力学
金属离子在吸附剂表面的吸附过程可分为扩散和吸附2个阶段。为了更好地解释Fe3O4@SiO2-T材料对Hg(II)的吸附速率控制过程,揭示吸附机理,分别采用准1级动力学模型和准2级动力学模型对实验数据进行了模拟,方程如(3)和(4)所示[25]:

式中,k1和k2分别为准1级动力学常数和准2级动力学常数,qe和qt分别为吸附平衡时和吸附时间为t时Hg(II)的吸附量,t为吸附时间。
材料对Hg(II)吸附动力学拟合结果如图7所示。
图7Fe3O4@SiO2-T吸附Hg(II)的动力学线性拟合
由图7可知,准1级动力学和准2级动力学方程的相关系数R2分别为0.4673和0.9997。准2级动力学方程拟合效果好。由准2级动力学方程得到的理论吸附量为1.33mg/g,与实际平衡吸附量1.25mg/g更接近。因此,Fe3O4@SiO2-T材料对水环境中的Hg(II)的吸附过程更符合准2级动力学,因此该吸附过程主要是表面吸附为主的扩散过程[26]。
2.3.2吸附等温线
吸附等温线一般用于描述平衡含量与吸附量的关系。采用Langmuir等温线和Freundlich等温线模型进一步分析Fe3O4@SiO2-T对Hg(II)的吸附机理。Langmuir吸附等温线主要假设吸附剂表面被单层吸附,吸附分子之间互不干扰,表面均匀,且表面活性部位有限[27]。Freundlich吸附等温模型是经验公式,适合表面不均匀的吸附剂,一般认为Freundlich吸附等温模型拟合度高的吸附属于多分子层吸附[27]。Langmuir方程为:
Freundlich方程为:
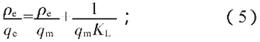
式中,KL和KF分别为Freundlich和Langmuir吸附常数,n为Freundlich常数。
Langmuir和Freundlich吸附等温线拟合方程如图8和图9所示。
图8Fe3O4@SiO2-T吸附Hg(II)的Langmuir等温线拟合
图9Fe3O4@SiO2-T吸附Hg(II)的Freundlich等温线拟合
由图8和图9可知,Langmuir吸附等温式的相关系数R2为0.9992,Freundlich吸附等温式的相关系数R2为0.7754。因此,Fe3O4@SiO2-T对Hg(II)的吸附更符合Langmuir吸附等温式描述的单分子层吸附规律。通过Langmuir吸附等温式拟合方程计算得出饱和吸附量qm为77.04mg/g,与实际的75.31mg/g相接近。
2.4材料的解吸与再生
在重金属吸附方法中,材料的稳定性和重复使用性是评价吸附剂性能的重要指标之一,决定了吸附过程的运行成本。为考察Fe3O4@SiO2-T的稳定性和再生性,对已吸附Hg(II)的材料进行解吸附,并重复1.4节中的操作,进行循环再生实验。
由溶液pH对Hg(II)吸附的影响可知,在酸性环境中,溶液中大量存在的H+能够破坏Hg(II)与N和S之间的配位作用,不利于Hg(II)的吸附。因此,选择0.5mol/L的HNO3为解吸液,进行循环吸附、解吸附操作。结果显示,循环使用10次以后,材料对Hg(II)的吸附率仍高达85%。这说明材料可多次重复使用,并且在酸性溶液中也具有良好的稳定性,这可显著降低吸附过程的运行成本。
3、结论
通过化学键合法,制备了劳氏紫功能化核壳型磁性纳米材料,实现了中性条件下Hg(II)的吸附,建立了1种新型Hg(II)吸附处理方法。主要结论有:
1)以磁性材料代替传统材料为吸附剂,分离回收吸附剂的时间仅为数10秒,大大减少了吸附时间,降低了操作成本;
2)含N和S配体官能团的引入增加了材料表面的活性吸附位点,材料对Hg(II)的吸附量高达77.04mg/g;
3)材料具有核壳结构,在溶液中具有良好的稳定性,可循环使用10次以上,吸附性能稳定;
4)Hg(II)在材料表面的吸附符合准2级动力学方程和Langmuir吸附等温式,该过程为单分子层吸附,吸附速率主要由表面吸附阶段控制。
吴春来,彭传云,卫应亮,张少文.劳氏紫功能化磁纳米材料对Hg(Ⅱ)的吸附性能[J].水处理技术,2020,46(07):20-25.
基金:河南省科技攻关计划项目(182102311049);河南省高等学校重点科研项目(18B150014);洛阳理工学院高层次人才科研启动项目(2017BZ14).

水质化学分析要求专业人员应用相应的化学试剂、合理的检测方法以及先进的检测设备等对水体的各项指标进行有效检测。在实际开展水质化学分析工作时,检验人员需要依据不同地区具体的水质情况,采取对应主成分分析法、模糊综合监测法等分析方法,严格依据样品采集、储存以及运输等不同环节的要求进行检验。
2023-09-01
有机膦-金配合物作为催化剂在有机合成反应中的应用一直是催化研究领域的热点之一,许多金配合物被证实能有效地催化活化炔烃、烯烃,甚至芳香化合物。然而大部分有机膦-金配合物具有催化活性的中间体稳定性不好,导致其催化活性及应用受到诸多限制,因此合成新型的有机膦-Au配合物并研究其结构与性质具有重要的意义。
2020-07-16
通信设备给生活带来便利的同时,也带来了日益严重的电磁干扰[1,2,3,4,5].长期生活在电磁辐射环境中,会给人的身体和心理带来不良影响,如人体免疫力降低.随着电子设备小型化,元器件间的电磁波相互干扰,进而缩短设备的使用寿命.手机辐射的电磁波会对精密仪器产生一定的干扰,影响仪器的正常工作.在雷达探测中,电磁干扰会导致军事打击的准确性降低[6,7].
2020-07-14
劳氏紫是一种含有N和S的有机试剂,和Hg(II)之间有较强的结合力。本研究采用化学键合方法,将劳氏紫联接到磁性纳米材料表面,制备一种劳氏紫修饰的功能化核壳型磁性纳米材料,对其进行表征,测试其磁响应性能,并研究对废水中重金属Hg(II)的吸附性能,以期对含Hg(II)废水的吸附处理具有借鉴作用。
2020-07-09![探讨{[Zn(L)(CH3COO)]•(H2O)}n(1)的结构表征与合成方法](https://91xueshu-1.oss-cn-hongkong.aliyuncs.com/uploads/2019/11/5ddf193d18cac_thumb.jpg)
本文选择了一个含苯甲酸和苯并咪唑基团的双功能配体4-(2-苯并咪唑基)苯甲酸(L)(Scheme1)。该配体中既有芳香羧基又有咪唑环,这两个基团都有很强的配位能力,协同效应下应该会制备出具有新颖结构和性能的配位聚合物。最终,在水热条件下,我们合成了L与Zn(II)的配位聚合物{[Zn(L)(CH3COO)]∙(H2O)}n(1)。X-射线单晶衍射实验发现该配位聚合物为2D结构。
2020-06-29
高校物理化学实验是一门重要的化学基础学科,在巩固加深物理化学理论课程中概念和理论的理解方面有着重要作用。中国海洋大学是一所具有海洋特色的综合性学校,涉海学科一直是我校特色优势化学科,如何结合当代蓝色经济发展的需求,将海洋特色和各专业特色融入到目前实验教学内容当中,丰富实验内容,激发学生学习兴趣,一直是我们实验教学队伍的研究内容。
2020-06-29
超级电容器作为当代应用最为广泛的绿色储能装置,在各市场领域发展前景广阔[1,2]。但因其能量密度不高、使用寿命短等缺陷而无法满足人们对超级电容器的更高性能需求,所以仍需对其性能进行改善。超级电容器性能的高低与电极材料的性能直接相关,而影响电极材料的电化学性能的主要因素有溶液pH、反应物的用量(比例)及反应温度等。
2020-06-29
本文首先通过水热法合成球状TiO2纳米颗粒,利用NaBH4在高温条件下将其还原成黑色TiO2,减小带隙增强对可见光的吸收。然后,将黑色TiO2颗粒在高温条件下与MoS2粉末相结合构建黑色水热法TiO2/MoS2异质结,有效抑制了光生空穴对的重合。同时,利用扫描电子显微镜(SEM)进行形貌结构分析。
2020-06-29
甲醇重整燃烧电池(以下简称“甲醇电池”)为了结构紧凑、控制便利,重整和启燃时均以甲醇水溶液为原料;冷启动时,热量主要由甲醇水溶液气化燃烧供给。因启动温度低、甲醇水溶液气化不足、氧化燃烧催化剂不耐湿、尾气空速大等因素,甲醇难充分燃烧,尾气中常存在一定的甲醇、甲醛等。
2020-06-29
在本文中,我们制备出具有中孔结构的TS-1分子筛,以它作为基底将金属Ga3+离子修饰于分子筛TS-1的表面,得到Ga3+离子改性的中孔分子筛材料。在室温紫外光辐照条件下,考察中孔结构对乙烷C—H键的活化以及对目标产物转化的影响。结果显示,中孔Ga3+-TS-1分子筛显示出极高的光诱导活化乙烷C—H键生成丁烷的能力。
2020-06-29我要评论

期刊名称:化学通报
期刊人气:6108
主管单位:中国科学院
主办单位:中国科学院化学研究所,中国化学会
出版地方:北京
专业分类:化学
国际刊号:0441-3776
国内刊号:11-1804/O6
邮发代号: 2-28
创刊时间:1934年
发行周期:月刊
期刊开本:16开
见刊时间:一年半以上


影响因子:2.741

影响因子:1.160

影响因子:1.215

影响因子:0.770

影响因子:0.374
您的论文已提交,我们会尽快联系您,请耐心等待!
你的密码已发送到您的邮箱,请查看!